PIN VÀ ẮC QUY KHÁC NHAU CHỖ NÀO
PIN VÀ ẮC QUY KHÁC NHAU Ở ĐIỂM NÀO?
1. PIN LÀ GÌ?
Năm 1800 nhà vật lí người Ý, Alessandro Volta (1745 - 1827) đã phát minh ra một thiết bị cung cấp điện gồm nhiều miếng đồng, kẽm hình tròn xếp trồng lên nhau, ngăn cách với nhau bằng một tấm giấy xốp tẩm dung dịch axít sunfuric (H2SO4) loãng. Xuất phát từ tiếng ý "Pile" (ám chỉ những miếng hình tròn xếp trồng lên nhau) nên thiết bị đó được gọi là Pin, để ghi nhận công lao của Volta, các nhà vật lí đặt tên cho thiết bị điện trên gọi là Pin Volta. Tên của Volta còn được lấy đặt cho đơn vị của điện áp (hiệu điện thế) và suất điện động của nguồn điện ký hiệu là V (phiên âm tiếng Việt là Vôn).

Cách tạo ra suất điện động của pin Volta:
Phản ứng hóa học tại bề mặt của tấm kẽm khi tiếp xúc với H2SO4
Zn + 2H -> Zn + H2
Phần bao ngoài tấm kẽm tiếp giáp với dung dịch axít tạo thành các ion Zndịch chuyển vào trong dung dịch axít khiến phần còn lại tấm kẽm bị mất ion dương nên tích điện âm.
Dòng các ion + từ tấm kẽm đi vào trong dung dịch H2SOtạo nên điện áp (hiệu điện thế) giữa tấm kẽm và dung dịch H2SOlà U1
Tại tấm đồng không xảy ra phản ứng hóa học với H2SO4 loãng, nhưng các ion H trong dung dịch H2SO4 loãng sẽ đến bám vào phần bên ngoài của tấm đồng hút lấy các electron bên trong tấm đồng. Tấm đồng mất electron nên nhiễm điện dương, dòng electron đi ra từ tấm đồng tạo nên điện áp (hiệu điện thế) giữa tấm đồng và dung dịch H2SOlà U2
Nhờ phản ứng hóa học giữa tấm kẽm (nhiễm điện âm) và tấm đồng (nhiễm điện dương) hình thành nên nguồn điện có suất điện động E=U2 - U1
Pin hoạt động dựa trên phản ứng hóa học được gọi là pin điện hóa. Ngày nay các loại pin điện hóa được cải tiến và phát triển để gọn nhẹ hơn nhưng về cơ bản đều hoạt động dựa trên phản ứng hóa học.
Các phản ứng hóa học trong pin chỉ xảy ra một chiều, sau khi kẽm (Zn) tác dụng hết với dung dịch H2SO4 tạo thành muối kẽm (ZnSO4) thì pin không còn điện năng, không thể đảo ngược quá trình ZnSOthành tấm kẽm như ban đầu nên không thể "sạc" lại điện cho pin.
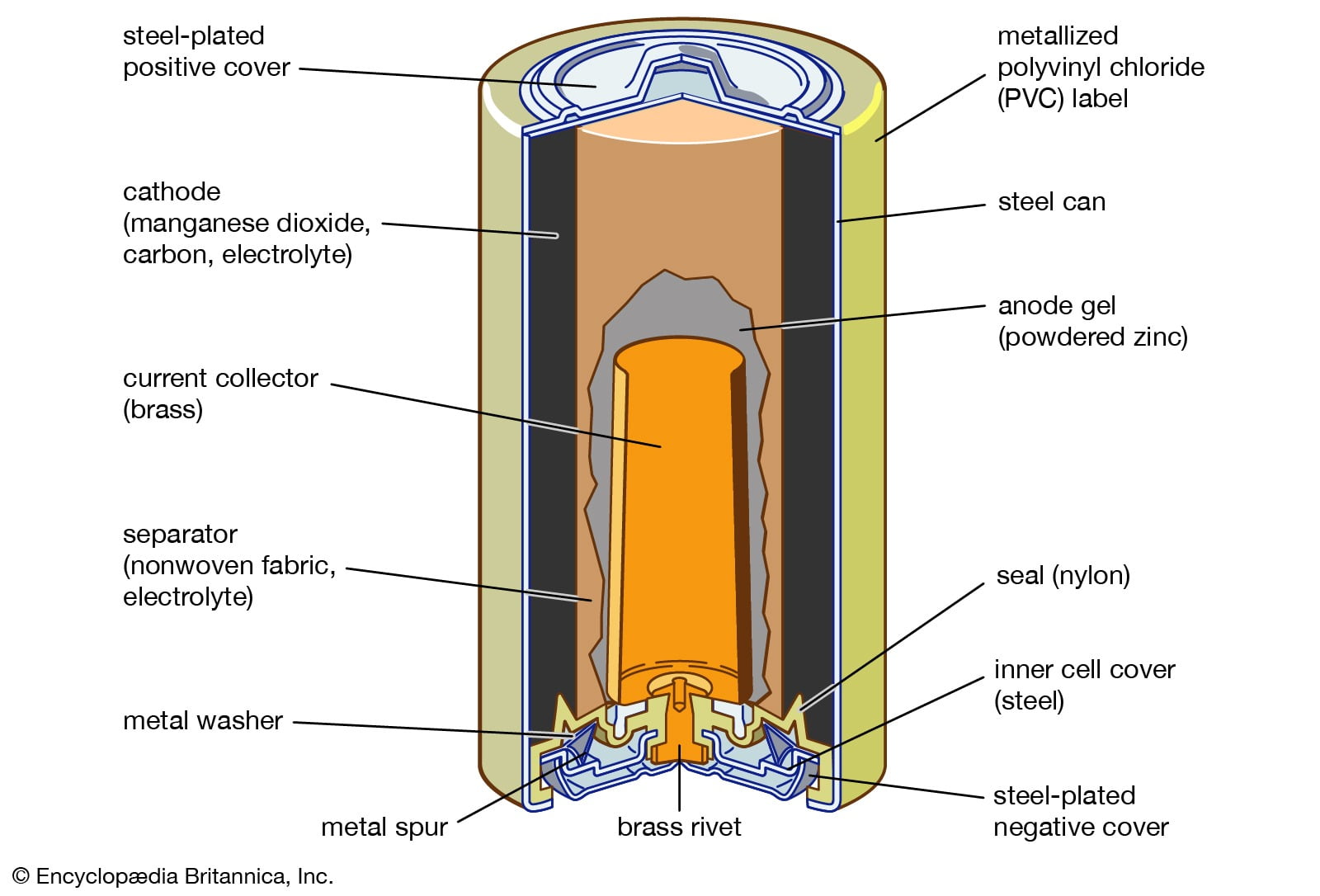
2. ẮC QUY LÀ GÌ?
Trong tiếp Pháp được gọi là Batterie d'accumulateurs, từ "ắc quy" trong tiếng Việt được đọc lái từ "accumulateurs" do thời gian dài đất nước ta bị thực dân Pháp đô hộ, một số từ trong tiếng Việt như khăn mùi xoa, ghi đông xe đạp, bê đan ... đều được vay mượn từ tiếng Pháp cho đến khi có tên gọi thay thế.
Ắc quy được phân loại theo kim loại làm điện cực như ác quy chì (cực dương bằng PbO2, cực âm là Pb), ác quy nickel-cadmium (Ni-Cad), ác quy nickel-metal-hydride (Ni-MH), ác quy Lithium-lon (Li-lon) ...ắc quy Lithium-lon (Li-lon) được sử dụng trong hầu hết các thiết bị điện thoại, máy tính bảng, laptop ...
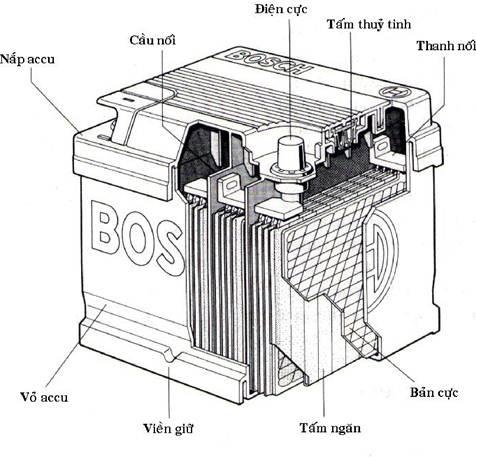
3. PHÂN BIỆT PIN VÀ ẮC QUY
Bằng mắt thường bạn sẽ không thể phân biệt được sự khác biệt giữa một viên pin sạc (ắc quy) và một viên pin thường.
Do hình dạng của "pin sạc" và pin khá là giống nhau, ngoài ra do thói quen sử dụng các thiết bị điện dùng "pin" thì nguồn cấp điện cho các thiết bị điện đều được mọi người gọi chung là pin (trừ những ắc quy có kích thước lớn cung cấp cho ô tô, xe đạp điện ... được mọi người gọi đúng là ắc quy)
Ngôn ngữ xuất phát từ cuộc sống giao tiếp, nên nhiều người cùng gọi các loại ắc quy dành cho điện thoại, laptop, máy ảnh ... là pin nên thành ra nó chở thành một danh từ chung khiến bạn khó phân biệt sự khác biệt giữa pin và ác quy.
Bài viết khác
- Nên học nghề gì trong năm 2026
- Khóa học xe máy điện cho thợ sửa xe | Học sửa xe điện thực tế
- ĐỘ XE ĐIỆN VÀ NHỮNG ĐIỀU CẦN LƯU Ý
- Top các trung tâm dạy nghề xe máy nổi tiếng Việt Nam
- CÓ NÊN SẠC XE ĐIỆN QUA ĐÊM KHÔNG?
- CÁCH XỬ LÝ KHI XE ĐIỆN BỊ NGẬP NƯỚC
- CÁCH NHẬN BIẾT XE ĐIỆN BỊ HƯ PIN
- CÁCH SẠC XE ĐIỆN ĐÚNG CÁCH
- SO SÁNH CHI PHÍ BẢO DƯỠNG CỦA XE MÁY XĂNG VÀ XE MÁY ĐIỆN
- CÁC THÓI QUEN LÀM GIẢM TUỔI THỌ XE MÁY
